- CHIMIE - Histoire
- CHIMIE - HistoireLa chimie est la science des transactions et des créations matérielles. Par elle se fonde la «cité culturelle» du matérialisme dont le champ est à jamais ouvert et illimité. La production d’idées et d’expériences qu’elle engendre dépasse, comme le rappelait opportunément Gaston Bachelard, la mémoire et l’imagination de tout homme.Relativement à ceux des autres sciences physiques, les énoncés de la chimie n’ont atteint que tardivement le mode de la rationalité, après un long parcours de rationalisations frustes et naïves. C’est que l’application du rationalisme à la forme fut autrement directe et souveraine que son application à la matière. La connaissance discursive de celle-ci ne peut s’accommoder des premières apparences qui, cependant, désignent et nourrissent, dans l’expérience des substances matérielles, les désirs de l’imaginaire. Aussi l’origine de la chimie est-elle inséparable des intentions de la magie.Tourmentant la matière, l’homme y projette les rêveries et l’insatisfaction de la subjectivité. À bon compte, il y trouve l’ivresse de manipuler des puissances obscures que manifestent la création de corps nouveaux et la production d’effets violents. Mais, en se rationalisant, la chimie assujettira les rêves de puissance aux exigences de la vérification objective et les réglera dans l’administration de forces uniformes.Cependant, le désir de la puissance demeure lié à la volonté de savoir; la chimie moderne, créatrice d’une complexité ordonnée de corps, inscrit cette liaison dans l’avenir de l’homme tandis qu’elle étend et enrichit l’ordre de la nature.1. Des quatre éléments naturels au concept d’élément chimiqueAu commencement de la chimie, l’homme, qui se croit à l’écoute des choses, déchiffre les qualités sensibles qu’il rencontre – c’est-à-dire invente – dans l’expérience de la matière. La connaître, c’est nommer ses variétés, mais aussi les inscrire dans un ordre cosmologique. L’évidence des traits manifestes les a d’abord fait tenir pour essentiels; d’où l’antique distinction des quatre éléments, la terre , l’eau , l’air et le feu , inscrits dans l’ordre sensoriel; quatre éléments qui ont leur lieu naturel et qui, par leur combinaison dans l’imaginaire cosmique, suffisent à faire un monde.Mais, dans les vues de la «préchimie», ces éléments supportent davantage des conflits de principes et des échanges de propriétés que des transactions effectives de matières; symboles de caractères sensibles, référés à des actions cosmiques, plus qu’identités inaliénables de substances. Dès lors, les agents chimiques sont plutôt des donateurs de propriétés et des révélateurs de puissances que des individus matériels.Il faut peut-être attendre Jungius, puis, surtout, en 1664, le Sceptical Chymist de Boyle pour trouver une définition générique satisfaisante de l’élément, rapportée à une nécessaire rationalité instrumentale. Boyle attribue justement la qualité élémentaire à tout corps indécomposable. C’est la technique qui définit l’élément, à la limite de l’analyse. Mais cette conception correcte demeure longtemps sans effet, tant sont impérieuses les images primitives de la quaternité élémentaire, comme le prouvent les assertions de Macquer, en plein XVIIIe siècle, dans l’un des ouvrages réputés de la littérature chimique, le Dictionnaire de chymie (1766): il déclare, tout comme Boyle cent ans plus tôt, qu’«on donne en chymie le nom d’élémens aux corps qui sont d’une telle simplicité que tous les efforts de l’art sont insuffisans pour les décomposer, et même pour leur causer aucune espèce d’altération; et qui [...] entrent comme [...] parties constituantes dans les combinations des autres corps, qu’on nomme pour cette raison, corps composés». Mais il conserve le système traditionnel: «Les corps auxquels on a reconnu cette simplicité sont le feu, l’air, l’eau et la terre la plus pure; parce qu’en effet les analyses, les plus complètes et les plus exactes qu’ont ait pu faire jusqu’à présent, n’ont jamais produit autre chose, en dernier ressort, que les unes ou les autres de ces quatre substances, ou toutes les quatre suivant la nature des corps qui ont été décomposés.» C’est véritablement par constance d’habitude doctrinale que, dans les «derniers ressorts» de ses analyses, ce bon chimiste ne reconnaissait pas les différences spécifiques qui lui auraient permis de rompre la détermination formelle des quatre éléments et de mettre à l’épreuve l’hypothèse qu’il formulait de leur caractère composite: «Il est très possible que ces substances, quoique réputées simples, ne le soient pas, qu’elles soient même très composées...» Il y avait là un grand obstacle théorique qui ne sera définitivement surmonté que par Cavendish et par Lavoisier.Il est bien significatif, à ce sujet, que des chimistes aussi attentifs que Hales ou Priestley, quand ils isolent et manipulent différents gaz, y voient difficilement des espèces matérielles individuées et les considèrent d’emblée comme des altérations ou des corruptions de l’élément air.Il ne faudrait pas s’imaginer, toutefois, que la défense doctrinale d’un Macquer illustre une radicale permanence de vue sur les quatre éléments. Leur association fut enrichie de distinctions dynamiques; l’eau, l’air et le feu ont été souvent réunis en une triade active par opposition à l’élément terrestre plus ou moins passif, conformément aux suggestions de l’expérience technique. Mais au XVIe siècle, on vit aussi Paracelse attribuer les pouvoirs réactifs de la matière au «mercure», au «soufre» et au «sel», c’est-à-dire à trois principes d’action qui sont en acte dans d’innombrables substances, mais qu’exhibent plus particulièrement trois corps: le mercure est le principe de la dissolution manifeste dans le vif-argent; de même que le principe de combustibilité, le soufre philosophique, se rencontre métonymiquement dans le soufre commun.Privilégier dans les substances matérielles des «principes», y localiser des qualités actives, c’est perpétuer la division et l’opposition des instances de la matière et de la forme. Ce ne sera qu’au terme de longs tâtonnements que les chimistes consentiront à reconnaître dans la foison obscure des corps naturels une pluralité ordonnée d’espèces matérielles élémentaires. Débrouiller la confusion des apparences, c’est développer une dialectique incessante entre la multitude des objets précis de l’observation positive et la simplification des catégories discursives.Faut-il rappeler, pour donner la mesure de cette mise en ordre, aujourd’hui scolaire, qu’il ne s’agissait rien moins, aux débuts de la chimie, que d’attribuer le même statut théorique et le même mode d’existence à des corps purs, comme l’or, presque inerte, à des métaux altérables comme le fer et le cuivre, aux «métalloïdes» comme le carbone des charbons impurs, comme le soufre qui cristallise parfois, comme le phosphore variable, à des gaz enfin, si malaisés à identifier de prime abord dans la multitude des «esprits»? Pour parvenir aux claires conceptions postlavoisiennes, il convenait justement de discerner l’individualité composite de gaz si proches, en apparence, de gaz élémentaires, reconnaître encore dans l’eau, considérée universellement par intuition comme première, une combinaison de deux gaz, et renoncer à voir dans le «calorique» un élément que Lavoisier lui-même conserve dans son système, puisque notre oxygène substantiel se composait pour lui de l’union du « principe oxygène » et du «calorique».En chimie, le simple n’est pas donné, mais conquis, comme le produit d’une technique d’homogénéisation tenace. Le développement de la chimie s’est articulé autour d’un retournement principiel, le renoncement aux injonctions des simplicités «naturelles» constitutives de l’apparence, au profit de simplicités artificielles d’essence phénoménotechnique.C’est au XVIIIe siècle que s’amorce décisivement cette mutation dans l’étude difficile des gaz et dans l’interprétation des phénomènes de combustion.2. L’étude des gaz ou la chimie pneumatiqueUne théorie empirique des gaz supposait d’abord la mise en œuvre d’une technique d’isolement. Au début du XVIIIe siècle, Hales inventa le dispositif simple mais indispensable de la cuve à eau, qui sera perfectionné quand on remplacera l’eau par le mercure. Hales recueillit ainsi de nombreux gaz dégagés par chauffage de diverses substances; mais il s’en tenait à mesurer les volumes libérées; ses expériences ne furent pas un gain pour la théorie moderne des éléments. Il pensait, comme le rappelle Lavoisier, que c’«était l’air lui-même, celui de l’atmosphère, qui se combinait avec les corps, soit par l’opération de la végétation et de l’économie animale, soit par les opérations de l’art». Pourtant, ses travaux de laboratoire aidèrent à franchir une étape méthodologique. Il avait montré que de l’«air» était présent, «fixe», dans un grand nombre de substances, et qu’on pouvait l’en extraire par la chaleur. Les différences organoleptiques reconnues entre les divers gaz produits dans la nature ou par l’art étaient attribuées à des accidents qui ne modifiaient pas le «fond» essentiel de l’«air», ces accidents pouvant être aussi bien un changement de disposition des atomes que l’entraînement des «parties les plus subtiles des corps», qui rendaient hypothétiquement compte des changements de propriétés.C’est à Black, si fort loué par Lavoisier, que revient la gloire de fonder positivement la chimie «pneumatique». Grâce à lui, le caractère d’espèce chimique d’un gaz, l’«air fixe», notre anhydride carbonique, est défini sans ambage. Il démontre, dans sa dissertation de 1754, que les différences chimiques entre «alcalis effervescents» (les carbonates) et alcalis caustiques (les bases alcalino-terreuses) étaient strictement imputables à l’«air fixe» combiné dans les carbonates. Outre la reconnaissance d’un «air» chimiquement distinct de l’air ordinaire, ses travaux, conduits avec une rigoureuse exactitude quantitative, impliquaient des propositions fondamentales, à savoir que la masse totale d’un système chimique ne varie pas et qu’un gaz combiné peut être pesé.Témoignage de la difficulté invétérée de rompre avec la représentation d’homogénéité de l’air, Black hésitait sur la nature de cet «air fixe», qu’il décrivit comme «une espèce d’air disposé et répandu dans l’atmosphère soit sous forme d’une poudre extrêmement subtile, ou peut-être sous celle d’un fluide élastique». La réaction chimique se constitue théoriquement dans ses expériences quand il démontre le transfert de l’«air fixe» de la craie à l’alcali volatil (l’ammoniaque). La formation de cristaux par la rencontre de deux gaz (l’anhydride carbonique et l’ammoniac) dans un tube de verre est une de ses démonstrations qui préparèrent les chimistes à rompre avec les notions obscures de la simplicité élémentaire, tout en détachant les phénomènes surprenants du merveilleux alchimique. La synthèse frappante du carbonate d’ammonium par Black rappelle aussi l’importance de certaines déterminations purement techniques; c’est parce que les chimistes ont pu opérer avec des instruments de verre que certains phénomènes décisifs ont été isolés et observés. Qu’on songe à la synthèse eudiométrique de l’eau par Cavendish ou à la dissociation thermique de l’oxyde rouge de mercure.À la suite de Black, l’étude positive des gaz se développe fructueusement. Cavendish isole et caractérise l’«air inflammable» (l’hydrogène) en 1766. Daniel Rutherford différencie, en 1772, l’«air fixe» (l’anhydride carbonique) de l’«air nuisible» (l’azote), résidu gazeux de la calcination des métaux. La même année, un expérimentateur génial, Priestley, inaugure ses publications sur la chimie pneumatique, isolant sous la cloche à mercure toute sorte de gaz, notamment l’«air nitreux» (l’oxyde azotique), l’«air d’acide marin» (le gaz chlorhydrique), l’«air d’acide nitreux» (le peroxyde d’azote), l’«air d’acide vitriolique» (l’anhydride sulfureux), etc., mais surtout l’«air déphlogistiqué» (l’oxygène): en 1774, il démontre qu’en chauffant sur la cuve à mercure du «mercurius praecipitatus per se» (l’oxyde mercurique rouge) à l’aide d’une «lentille ardente» on produit un gaz insoluble dans l’eau, excitant les combustions et se colorant en brun au contact de l’«air nitreux». Scheele avait déjà, en 1772, identifié cet «air du feu», mais différé l’annonce de sa découverte jusqu’en 1777, date de parution de son Traité chimique de l’air et du feu . Mais Bayen, en 1774, avant même Priestley, avait, lui aussi, obtenu l’oxygène par dissociation thermique de l’oxyde rouge. Dès lors, l’avenir de la chimie positive se dessine promptement. En février 1773, à la veille de systématiser les expériences de ses prédécesseurs, Lavoisier notait que «tout le travail» qu’il allait reprendre lui paraissait «fait pour occasionner une révolution en physique et en chimie». Cette révolution qu’il pressentait allait précisément s’articuler autour des phénomènes d’oxydation et se développer dans le retournement radical de la théorie du phlogistique, qui constitua la première grande généralisation discursive de l’ensemble des phénomènes chimiques.3. Première théorisation cohérente: le phlogistiqueCette théorie s’est imposée pendant tout le XVIIIe siècle à la suite de Stahl qui a diffusé et développé une conception de Becher. Dans sa Physica subterranea (1667), celui-ci avait imaginé que l’élément terrestre se subdivise en trois espèces, dont l’une, la terra pinguis , serait caractéristique des corps inflammables. Dans cette vue imaginaire, la flamme est considérée comme un phénomène de portée essentielle dont l’évidence immédiate masque la réalité substantielle. À la suite de Becher, Stahl postule l’existence, dans tout corps combustible, d’un principe, le phlogiston , qui serait libéré avec la flamme. Les corps, tel le charbon de bois, qui brûlent sans laisser de résidu appréciable, étaient supposés les plus riches en phlogistique, contrairement aux corps comme les métaux dont la calcination abandonne un important résidu de chaux . L’expérience attestait qu’on pouvait reformer les métaux par chauffage de leur chaux intimement mêlée à du charbon de bois; la chaux étant ainsi convertie, on trouvait dans ce fait un fondement expérimental à la théorie qui assignait une circulation du principe de l’inflammabilité dans l’ensemble des substances. Cette théorie demeura d’abord confinée dans les cercles germaniques. Longtemps on en fit peu de cas en Grande-Bretagne et elle ne pénétra que tardivement en France, où les chimistes de l’Académie s’obstinaient à l’analyse des cendres végétales ou à spéculer sur l’affinité. Ce n’est qu’après 1742 que la théorie sera popularisée par les conférences de Rouelle au Jardin royal des plantes, à Paris, où elle ne tardera pas à être renversée par la «chimie française».L’une des grandes difficultés que rencontrait la théorie du phlogistique consistait dans l’interprétation d’un phénomène constant anciennement remarqué, l’augmentation du poids des métaux par calcination. Jean Rey avait déjà proposé des explications de ce fait dans ses Essays de 1630. Pour rendre compte du phénomène, on alla par la suite jusqu’à supposer que le phlogistique avait une pesanteur négative. Lavoisier sut systématiser les observations de ses prédécesseurs, répéta leurs expériences et comprit, dès 1772, que toute combustion résulte d’une combinaison avec un élément de l’air: conclusion qu’il développe en 1775 devant l’Académie dans une communication sur la Nature du principe qui se combine aux métaux au cours de la calcination en augmentant leur poids . Le système du phlogistique se trouve retourné par Lavoisier qui change les signes des déplacements tout en assurant la constance globale du transit des substances dans les métamorphoses matérielles. Avec lui, se consomme le renversement phénoménotechnique qui, dans les combustions, destitue la flamme de son privilège de première apparence, au profit de la considération positive des produits de la réaction; cela permet à Lavoisier, dans une profonde rupture de phénoménalité, de démontrer que la respiration est une combustion sans flamme. Ainsi se constitue scientifiquement un nouveau régime de la conception des transits matériels, défini par la comparaison analytique et quantitative de l’état initial et l’état final. En même temps que Cavendish, mais sur un fond de théorie différent, Lavoisier, qui définit l’hétérogénéité chimique sous l’homogénéité physique apparente, provoque, selon la forte expression de G. Bachelard, une «défaite totale de l’immédiat». Désormais, la simplicité, autrefois tenue pour initiale, devient positivement un résultat, au terme d’une série de décompositions analytiques.C’est cette pensée analytique qui se développe, enfin, dans la majestueuse systématisation de nomenclature instituée par Lavoisier. Son tableau lexical figure l’univers analysé dans la coïncidence rationnellement conquise des substances et des substantifs. Lavoisier, comme l’écrit F. Dagognet, a révolutionné les deux tâches de la nomenclature et de la classification, «parce que la combustion (qui réunit le feu, l’eau, la terre et l’air) lui a montré que les composés se créaient par juxtaposition ou agglomération. Semblablement, le mot n’est bâti que de lettres. Pour comprendre le monde, l’ordonner et le refléter dans un discours qui le livre, il suffit de le fractionner et de ressaisir l’alphabet avec lequel il a été composé». Avec le Traité élémentaire de Chymie de 1789 s’achève la liquidation de l’ancienne chimie, en dépit de propositions erronées comme le maintien par Lavoisier de la lumière et du calorique parmi les éléments, ou l’attribution universelle de la fonction acide à l’oxygène. La théorie lavoisienne de l’oxydation fut rapidement suivie, sauf par quelques défenseurs attardés du phlogistique (Von Crell en Allemagne et Retzius en Suède).4. La stœchiométrieLe rôle de Lavoisier ne s’est pas limité à donner une nouvelle vision de l’ordre matériel, il a donné en même temps un nouveau style au travail du chimiste qui désormais introduit le quantitatif dans le qualitatif. À vrai dire, c’est à la clarté prestigieuse des exposés qu’il faut imputer l’illustration de cette nouvelle exigence qui s’annonçait déjà: l’attestent notamment les travaux de Kirwan et de Wenzel, qui s’attachèrent à l’étude des rapports quantitatifs dans la double décomposition des sels, et surtout les travaux de Richter dont la thèse de 1789, De usu matheseos in chemia , dit bien par son titre le nouveau régime de positivité recherché par les chimistes. Dans son principal ouvrage publié en 1792-1793, sur l’Art de la mesure des éléments chimiques , il introduit les lois de la neutralité chimique et pose les fondements de la stœchiométrie en faisant apparaître la constance de rapports pondéraux dans la composition de diverses familles de corps. Son œuvre n’eut pas le retentissement qu’elle méritait, car Richter conserva les présupposés de la théorie du phlogistique et omit de calculer dans un système cohérent les valeurs des poids équivalents à partir d’une base commune; ce qui fut heureusement accompli par Franz Fischer dans sa publication des équivalents richteriens sur la base de 100 pour l’acide sulfurique. La publication, en 1803, du tableau des poids équivalents dans l’Essai de statique chimique de Berthollet fit connaître au public savant l’originalité de la stœchiométrie. Mais il est piquant de constater que Berthollet, diffuseur des thèses richteriennes, professait que la composition quantitative des combinaisons chimiques n’était pas constante, mais dépendait plutôt des masses relatives de réactifs; par là, il pressentait l’idée juste de l’action de masse , mais la postérité lui donnera tort, au bénéfice de son ardent contradicteur Proust, défenseur de la thèse des proportions constantes dans les combinaisons. Les règles de proportionnalité supposées par la stœchiométrie trouveront une expression schématique dans l’hypothèse atomique de Dalton proposée dès 1803 à Manchester, mais répandue seulement en 1807, dans le New System of Chemistry de Thomson. Contrairement à une opinion encore soutenue, Dalton n’a pas cherché d’abord à interpréter les lois empiriques de proportionnalités pondérales notifiées par les chimistes précédents, mais il posa comme première l’intuition de l’hypothèse atomique, reprise aux Anciens. Il se représentait que si les atomes substantiels demeurent invariables dans les transformations de la chimie, chaque particule élémentaire ne peut s’unir qu’à un atome ou à un petit nombre fini d’atomes d’autres éléments; et, par suite, le rapport des poids des atomes doit se retrouver dans le rapport pondérable des composants d’une combinaison. Mais faute de pouvoir, comme on le fait avec les techniques contemporaines, déterminer le nombre des atomes engagés réellement dans une combinaison unique de deux éléments, il admit arbitrairement que, en ce cas, ces deux éléments s’unissent atome pour atome. Pour Dalton, l’eau est composée d’un atome d’hydrogène et d’un atome d’oxygène, contrairement à ce qui sera admis par la suite. Si, avec Dalton, on prend 1 pour masse atomique de l’hydrogène, il est impossible par simple analyse chimique de décider si l’eau répond à la composition HO (avec, pour masse atomique de l’oxygène, 8) ou H2O avec, en conséquence, 16 pour masse de l’atome d’oxygène. Quant au rapport de composition, les deux propositions sont identiques. C’était une difficulté radicale, qui demandera plus de cinquante ans pour être définitivement résolue. Dalton qui s’intéressait à la météorologie physique avait trouvé que la proportion de l’oxygène dans l’atmosphère est constante et, notamment, indépendante de la pression atmosphérique. En France, Gay-Lussac s’occupait également de physique des gaz, et trouva comme Dalton, et à peu près en même temps, la loi de dilatation uniforme des gaz, assignant la même valeur, 1/266, au coefficient de dilatation, valeur qui sera corrigée par la suite par Regnault et Magnus, qui donneront indépendamment la valeur désormais classique de 1/273. Mais c’est bien à Gay-Lussac qu’il faut attribuer les déterminations appelées à débrouiller les difficultés de la théorie atomique. Il montra en 1805 que les volumes d’oxygène et d’hydrogène qui réagissent l’un avec l’autre sont exactement dans le rapport de 1 à 2. Par la suite, il entreprit l’étude volumétrique d’autres combinaisons (ammoniac + gaz chlorhydrique, anhydride sulfureux + oxygène, etc.) et put en induire que les volumes des gaz entrant en réaction, ainsi que ceux des combinaisons gazeuses sont entre eux dans des rapports entiers proches de l’unité. Nous savons maintenant que la loi de Gay-Lussac, pas plus que celle de Boyle-Mariotte, n’est rigoureusement exacte; sans doute sont-elles vérifiées avec une bonne approximation pour certains gaz tels que l’hydrogène, l’oxygène et l’azote qui ont un bas point d’ébullition dans l’échelle thermométrique; mais des vapeurs, tel l’anhydride carbonique dont la liquéfaction est plus aisée, s’écartent davantage du modèle théorique des « gaz parfaits » que définissent ces lois. Néanmoins, tous les gaz manifestent (avec les solutions diluées) par rapport aux autres états de la matière une identité structurale. Cette supposition devait s’organiser par la médiation d’une hypothèse formulée en 1811 par Avogadro. Selon lui, dans les mêmes conditions de température et de pression, des volumes identiques de divers gaz contiennent le même nombre de molécules. Cette hypothèse très hardie demeura longtemps sans audience; tout au plus trouve-t-on Ampère pour professer les mêmes idées propres à expliquer la loi de dilatation de Gay-Lussac, et à interpréter la simplicité des lois volumétriques de combinaison, compte tenu de l’hypothèse de Dalton, puisque dans ces vues il ne survient jamais que la réunion d’un petit nombre d’«atomes» d’un élément à un petit nombre d’«atomes» d’un autre élément. Cependant, une grave difficulté se présentait, puisqu’il était avéré qu’un volume d’hydrogène se combine à un demi-volume d’oxygène pour former un volume d’eau. Or, dans l’hypothèse daltonienne, il faut admettre la présence d’au moins une «molécule» d’oxygène dans chaque «molécule» d’eau. Si l’on suppose la synthèse limitée à la formation d’une molécule d’eau, le volume final doit, dans l’hypothèse d’Avogadro, être celui d’une molécule quelconque, donc celui d’une molécule d’oxygène. Pour éviter de conclure que les «molécules» d’oxygène occupent dans la vapeur d’eau un volume double de celui qui est occupé par l’élément, Avogadro fut conduit à admettre la composition de la molécule de l’oxygène élément en deux molécules «élémentaires», en deux atomes dirions-nous aujourd’hui, qui se séparent pour entrer en combinaison dans la molécule d’eau. Si bien qu’on est conduit au schéma:
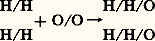 dans lequel la molécule d’hydrogène est également composée, qui s’accorde avec les proportions volumétriques publiées par Gay-Lussac (deux volumes d’hydrogène plus un volume d’oxygène forment deux volumes d’eau). La diatomicité de l’hydrogène d’abord supposée par homologie avec l’oxygène fut confirmée expérimentalement par la combinaison de l’azote avec l’hydrogène. Ces notions, qui nous apparaissent aujourd’hui d’une lumineuse simplicité dans leur formulation désormais classique, n’eurent d’abord aucun retentissement. La distinction foncière entre atomes et molécules échappait aux chimistes. Ils mirent longtemps à se convaincre qu’il faille séparer, dans la représentation des éléments chimiques, l’atome, plus petite partie pouvant entrer en combinaison, de la molécule, plus petite partie susceptible d’existence propre. Il faudra, finalement, attendre la seconde moitié du XIXe siècle pour que ces vues claires soient universellement reçues. Jusque vers 1860, la plupart des chimistes étaient engagés dans des systèmes incohérents d’équivalents , qualifiés de poids atomiques, sans qu’ils puissent s’accorder sur un terme unique de référence. Sans doute Laurent, Gerhardt et Frankland élaborèrent-ils des théorisations cohérentes à nos vue classiques, mais il faut attendre l’article de S. Cannizzaro «Sunto di un corso di filosofia chimica», publié en 1858 dans Il Nuovo Cimento , pour voir clairement systématisées la théorie d’Avogadro et la claire distinction entre atomes et molécules. Fortement impressionné par la cohérence doctrinale des thèses de Cannizzaro qu’il connut en 1860 pendant le premier Congrès international de chimistes à Karlsruhe, Lothar Meyer leur assura un succès définitif en les développant dans son Modernen Theorien der Chemie de 1864.5. La détermination des masses atomiquesLaborieuse tâche fondamentale qu’accomplirent les chimistes du XIXe siècle, la détermination des masses atomiques fut d’abord l’œuvre de Berzelius dont la méticuleuse précision et l’opiniâtreté analytique ont été un modèle éclatant. Il fut l’initiateur du symbolisme des formules de constitution dont l’écriture ainsi abrégée est d’un si grand secours pour l’intellect des chimistes modernes. Il abandonne cependant la référence à l’hydrogène qu’avait choisie Dalton et lui substitue l’oxygène noté 100, parce que la multiplicité de ses combinaisons le recommande comme terme de comparaison et surtout parce que les combinaisons oxygénées lui semblaient conduire aux analyses les plus précises. Cependant, l’évaluation des masses atomiques rencontrait maintes difficultés: la théorie atomique n’était pas fermement établie et la distinction entre molécules et atomes ne devait s’imposer que tardivement; on avait donc souvent peine à dénombrer les atomes présents dans une combinaison. Les chimistes durent alors combiner plus ou moins intuitivement et avec plus ou moins de bonheur les indices fournis par les considérations d’analogies structurales (familles naturelles de composés, théorie de l’isomorphisme de Mitscherlich) avec des grandeurs physiques. Parmi celles-ci, la mesure des densités gazeuses compte particulièrement; son utilité apparaît clairement si l’on adopte l’hypothèse d’Avogadro: dans des conditions déterminées de température et de pression, le poids d’un volume donné de gaz ne dépend que de la masse des molécules; car, si les molécules d’un gaz sont n fois plus lourdes que celles d’un autre, leur nombre étant supposé le même dans des volumes égaux, le même rapport doit apparaître dans la masse de ces volumes. Du coup, une caractéristique chimique, la masse moléculaire, est assignable grâce à une détermination purement physique. Malheureusement, Dumas qui proposa, un des premiers, une méthode sûre de la détermination des densités en fit un usage théorique confus qui nuisit à l’essor de la théorie atomique. Une autre relation physique applicable à la détermination des masses atomiques fut proposée dès 1819 par Dulong et Petit: tous les atomes ont même capacité calorifique, c’est-à-dire qu’ils requièrent la même quantité de chaleur pour parcourir le même échauffement, ou, en d’autres termes, la masse atomique d’un corps est inversement proportionnelle à sa chaleur spécifique. Rigoureusement parlant, le domaine de validité de cette loi est limité dans l’échelle des températures; cependant, Dulong et Petit parvinrent à des déterminations exactes de masses atomiques, corrigeant ainsi des évaluations de Berzelius qu’ils ramenèrent à la moitié de la valeur assignée par le chimiste suédois. Par un usage judicieux des lois des combinaisons gazeuses, de la considération des isomorphismes et des analogies, des mesures de densité de vapeur et des chaleurs spécifiques, les chimistes purent progressivement s’accorder sur des masses atomiques que confirmèrent les mesures électrochimiques dont Faraday avait fait les premières en 1833. Mais ce n’est, en définitive, que vers les années 1860 que le système de la chimie minérale commence à présenter une cohérence de notation et de représentation qui puisse à bon droit apparaître fermement établie. Les éléments chimiques fonctionnent dans ce système comme des invariants fondamentaux engagés dans des combinatoires diverses selon des règles de composition homogène. Point n’est besoin alors de se décider sur la forme, la nature ou même l’existence des atomes; la collection des corps de la chimie peut s’accroître par toute sorte de synthèses; ils sont désormais qualifiables, analysables, définissables dans un système universel d’équivalents pondéraux immuables qui sont en relation, sans qu’il y ait lieu de s’inquiéter du nombre d’Avogadro, c’est-à-dire du nombre réel d’atomes stricto sensu contenus dans la masse de chaque atome-gramme. Toute une science des transactions matérielles, analyse et synthèse, se construit sans nulle défaillance; elle est représentable sans résidu ni doutes, avec pour seul principe l’identité de la formulation de composition moléculaire de chaque espèce chimique. Ce n’est que plus tard que l’on éprouvera le besoin et que l’on trouvera les moyens de compter, mesurer et figurer les molécules réelles; la chimie organique qui pendant un siècle est définie essentiellement comme celle du carbone sera la didactique de la figuration approchée, au moyen de laquelle, cependant, se constitueront et s’organiseront les principaux concepts opératoires d’une théorie des structures et des associations atomiques. C’est alors que se déploie l’histoire du concept variable de valence qui règle les rapports arithmétiques puis topologiques des atomes dans les molécules puis dans leurs associations. Cependant, le tableau des éléments s’ordonne, avant de devenir plus complexe par la découverte des isotopes, dans une vaste synthèse intellectuelle, la classification périodique des éléments de Mendeleïev.Enfin, la cinétique et les déterminations énergétiques des réactions et des combinaisons achèveront de constituer l’édifice théorique de la chimie moderne dont le développement serait bien trop long à retracer ici. D’autant qu’il aboutit actuellement à une ramification des spécialisations productrice d’une avalanche de textes (annuellement plus de 50 000 articles!). Le classement des travaux des chimistes depuis un siècle est nécessairement imparfait et l’articulation des phases de leur développement fatalement artificielle. Cependant, à propos des articles ÉLÉMENTS CHIMIQUES, MOLÉCULE, SYNTHÈSE CHIMIQUEet VALENCE, et au cours des diverses monographies de savants, le lecteur trouvera des indications plus particulières sur l’histoire de ces notions théoriques. Reste que les progrès récents de la chimie peuvent être rapportés à l’individualisation technique et institutionnelle de ce qui est qualifié chimie-physique: c’est la caractérisation et l’étude des processus chimiques par des méthodes plus particulièrement physiques. Faraday, Berthelot, Bunsen, Kopp, Mayer apparaissent à cet égard comme des précurseurs d’une évolution qui se manifeste brillamment avec Ostwald, le fondateur du Zeitschrift für physikalische Chemie en collaboration avec Van’t Hoff. Avec l’avènement de la physico-chimie à la fin du XIXe siècle se réalise pleinement le projet formé en 1789 dans la dissertation de Richter De usu matheseos in chemia .
dans lequel la molécule d’hydrogène est également composée, qui s’accorde avec les proportions volumétriques publiées par Gay-Lussac (deux volumes d’hydrogène plus un volume d’oxygène forment deux volumes d’eau). La diatomicité de l’hydrogène d’abord supposée par homologie avec l’oxygène fut confirmée expérimentalement par la combinaison de l’azote avec l’hydrogène. Ces notions, qui nous apparaissent aujourd’hui d’une lumineuse simplicité dans leur formulation désormais classique, n’eurent d’abord aucun retentissement. La distinction foncière entre atomes et molécules échappait aux chimistes. Ils mirent longtemps à se convaincre qu’il faille séparer, dans la représentation des éléments chimiques, l’atome, plus petite partie pouvant entrer en combinaison, de la molécule, plus petite partie susceptible d’existence propre. Il faudra, finalement, attendre la seconde moitié du XIXe siècle pour que ces vues claires soient universellement reçues. Jusque vers 1860, la plupart des chimistes étaient engagés dans des systèmes incohérents d’équivalents , qualifiés de poids atomiques, sans qu’ils puissent s’accorder sur un terme unique de référence. Sans doute Laurent, Gerhardt et Frankland élaborèrent-ils des théorisations cohérentes à nos vue classiques, mais il faut attendre l’article de S. Cannizzaro «Sunto di un corso di filosofia chimica», publié en 1858 dans Il Nuovo Cimento , pour voir clairement systématisées la théorie d’Avogadro et la claire distinction entre atomes et molécules. Fortement impressionné par la cohérence doctrinale des thèses de Cannizzaro qu’il connut en 1860 pendant le premier Congrès international de chimistes à Karlsruhe, Lothar Meyer leur assura un succès définitif en les développant dans son Modernen Theorien der Chemie de 1864.5. La détermination des masses atomiquesLaborieuse tâche fondamentale qu’accomplirent les chimistes du XIXe siècle, la détermination des masses atomiques fut d’abord l’œuvre de Berzelius dont la méticuleuse précision et l’opiniâtreté analytique ont été un modèle éclatant. Il fut l’initiateur du symbolisme des formules de constitution dont l’écriture ainsi abrégée est d’un si grand secours pour l’intellect des chimistes modernes. Il abandonne cependant la référence à l’hydrogène qu’avait choisie Dalton et lui substitue l’oxygène noté 100, parce que la multiplicité de ses combinaisons le recommande comme terme de comparaison et surtout parce que les combinaisons oxygénées lui semblaient conduire aux analyses les plus précises. Cependant, l’évaluation des masses atomiques rencontrait maintes difficultés: la théorie atomique n’était pas fermement établie et la distinction entre molécules et atomes ne devait s’imposer que tardivement; on avait donc souvent peine à dénombrer les atomes présents dans une combinaison. Les chimistes durent alors combiner plus ou moins intuitivement et avec plus ou moins de bonheur les indices fournis par les considérations d’analogies structurales (familles naturelles de composés, théorie de l’isomorphisme de Mitscherlich) avec des grandeurs physiques. Parmi celles-ci, la mesure des densités gazeuses compte particulièrement; son utilité apparaît clairement si l’on adopte l’hypothèse d’Avogadro: dans des conditions déterminées de température et de pression, le poids d’un volume donné de gaz ne dépend que de la masse des molécules; car, si les molécules d’un gaz sont n fois plus lourdes que celles d’un autre, leur nombre étant supposé le même dans des volumes égaux, le même rapport doit apparaître dans la masse de ces volumes. Du coup, une caractéristique chimique, la masse moléculaire, est assignable grâce à une détermination purement physique. Malheureusement, Dumas qui proposa, un des premiers, une méthode sûre de la détermination des densités en fit un usage théorique confus qui nuisit à l’essor de la théorie atomique. Une autre relation physique applicable à la détermination des masses atomiques fut proposée dès 1819 par Dulong et Petit: tous les atomes ont même capacité calorifique, c’est-à-dire qu’ils requièrent la même quantité de chaleur pour parcourir le même échauffement, ou, en d’autres termes, la masse atomique d’un corps est inversement proportionnelle à sa chaleur spécifique. Rigoureusement parlant, le domaine de validité de cette loi est limité dans l’échelle des températures; cependant, Dulong et Petit parvinrent à des déterminations exactes de masses atomiques, corrigeant ainsi des évaluations de Berzelius qu’ils ramenèrent à la moitié de la valeur assignée par le chimiste suédois. Par un usage judicieux des lois des combinaisons gazeuses, de la considération des isomorphismes et des analogies, des mesures de densité de vapeur et des chaleurs spécifiques, les chimistes purent progressivement s’accorder sur des masses atomiques que confirmèrent les mesures électrochimiques dont Faraday avait fait les premières en 1833. Mais ce n’est, en définitive, que vers les années 1860 que le système de la chimie minérale commence à présenter une cohérence de notation et de représentation qui puisse à bon droit apparaître fermement établie. Les éléments chimiques fonctionnent dans ce système comme des invariants fondamentaux engagés dans des combinatoires diverses selon des règles de composition homogène. Point n’est besoin alors de se décider sur la forme, la nature ou même l’existence des atomes; la collection des corps de la chimie peut s’accroître par toute sorte de synthèses; ils sont désormais qualifiables, analysables, définissables dans un système universel d’équivalents pondéraux immuables qui sont en relation, sans qu’il y ait lieu de s’inquiéter du nombre d’Avogadro, c’est-à-dire du nombre réel d’atomes stricto sensu contenus dans la masse de chaque atome-gramme. Toute une science des transactions matérielles, analyse et synthèse, se construit sans nulle défaillance; elle est représentable sans résidu ni doutes, avec pour seul principe l’identité de la formulation de composition moléculaire de chaque espèce chimique. Ce n’est que plus tard que l’on éprouvera le besoin et que l’on trouvera les moyens de compter, mesurer et figurer les molécules réelles; la chimie organique qui pendant un siècle est définie essentiellement comme celle du carbone sera la didactique de la figuration approchée, au moyen de laquelle, cependant, se constitueront et s’organiseront les principaux concepts opératoires d’une théorie des structures et des associations atomiques. C’est alors que se déploie l’histoire du concept variable de valence qui règle les rapports arithmétiques puis topologiques des atomes dans les molécules puis dans leurs associations. Cependant, le tableau des éléments s’ordonne, avant de devenir plus complexe par la découverte des isotopes, dans une vaste synthèse intellectuelle, la classification périodique des éléments de Mendeleïev.Enfin, la cinétique et les déterminations énergétiques des réactions et des combinaisons achèveront de constituer l’édifice théorique de la chimie moderne dont le développement serait bien trop long à retracer ici. D’autant qu’il aboutit actuellement à une ramification des spécialisations productrice d’une avalanche de textes (annuellement plus de 50 000 articles!). Le classement des travaux des chimistes depuis un siècle est nécessairement imparfait et l’articulation des phases de leur développement fatalement artificielle. Cependant, à propos des articles ÉLÉMENTS CHIMIQUES, MOLÉCULE, SYNTHÈSE CHIMIQUEet VALENCE, et au cours des diverses monographies de savants, le lecteur trouvera des indications plus particulières sur l’histoire de ces notions théoriques. Reste que les progrès récents de la chimie peuvent être rapportés à l’individualisation technique et institutionnelle de ce qui est qualifié chimie-physique: c’est la caractérisation et l’étude des processus chimiques par des méthodes plus particulièrement physiques. Faraday, Berthelot, Bunsen, Kopp, Mayer apparaissent à cet égard comme des précurseurs d’une évolution qui se manifeste brillamment avec Ostwald, le fondateur du Zeitschrift für physikalische Chemie en collaboration avec Van’t Hoff. Avec l’avènement de la physico-chimie à la fin du XIXe siècle se réalise pleinement le projet formé en 1789 dans la dissertation de Richter De usu matheseos in chemia .
Encyclopédie Universelle. 2012.
